Tabla 2 Causas conocidas de osteoporosis secundarias

Hugo Gutiérrez Crespo 2
El artículo se refiere a la osteoporosis, en el que se hace la definición y explica las consecuencias de esta enfermedad, luego realiza una revisión de los antecedentes históricos en la que evoluciona el diagnóstico de osteoporosis así como su definición y el riesgo de fractura. Otro aspecto tratado es el referente a la clasificación de la osteoporosis, el cual la divide en involutiva y secundaria, se hace referencia también a la epidemiología, lo que muestra éste problema a nivel mundial, incluyendo el Perú. Se realiza también la descripción de la fisiopatología de la osteoporosis, estableciendo la relación entre menopausia y masa ósea, analiza además la clínica y el tratamiento, como el rol de los biofosfonatos, el estradiol, la Vitamina D y demás componentes que intervienen en la síntesis ósea.
ABSTRACT
The article refers to the osteoporosis itself, in the one that does the definition itself and explains the outcome of this disease, next a revision of the historic background that he evolves in accomplishes osteoporosis's diagnosis as well as his definition and the risk of fracture. Another processed aspect is the relating to osteoporosis's classification, which divides it at involutive and secondary, reference does itself also to the epidemiology that shows this worldwide problem, including the Peru. It’s accomplishes also the description of the physiopathology of osteoporosis, establishing the relation among menopause and osseous mass, he examines besides the clinic and the treatment, like the list of biofosfonatos, the estradiol, the vitamin D and besides component that they intervene in the osseous synthesis.
La osteoporosis es considerada hoy en día como la gran epidemia silente. Sin embargo, es una patología en gran parte desconocida para los internistas y, a pesar de tener una gran prevalencia y creciente incidencia, han tenido poco protagonismo en su tratamiento clínico. Mucho se ha avanzado en los últimos años en los conocimientos fisiopatogénicos, diagnósticos y terapéuticos de la enfermedad, y podemos afirmar que, por su característica multidisciplinaria, debe entrar dentro del ámbito de la Medicina Interna.
A partir de los 50 años, una mujer tiene un riesgo de casi un 40% de sufrir alguna fractura osteoporótica durante el resto de su vida (1).
El correcto estudio y tratamiento de la enfermedad exige una aproximación multidisciplinaria, que es precisamente la que caracteriza el pensamiento del internista. Ello es así por diferentes motivos: en su condicionamiento poligénico intervienen genes vinculados a la regulación de las lipoproteínas o a los efectos que condicionan la respuesta de un receptor hormonal a diversos ligandos; en su etiopatogenia influyen factores locales autocrinos y paracrinos así como factores hormonales sistémicos; existen enfermedades internas que afectan a diferentes órganos y sistemas e inducen osteoporosis y, en sentido opuesto, la osteoporosis puede ocasionar alteraciones en diversos órganos y aparatos; numerosos tratamientos comúnmente empleados en clínica influyen en uno u otro sentido en la salud ósea; por ultimo, la enfermedad en sí misma origina fracturas, dolor crónico, limitaciones funcionales y frecuentemente, desencadena complicaciones potencialmente letales.
El tratamiento de la osteoporosis requiere también una visión amplia y global, valorando diversos aspectos médicos que van más allá de la misma pero que, de alguna manera, interaccionan o interfieren con ella. Así, es aconsejable efectuar una evaluación nutricional de los pacientes (10). En el caso de que un paciente sea proclive a tener caídas, debe realizarse una cuidadosa valoración clínica, incidiendo especialmente en los aspectos neurológicos y cardiológicos en búsqueda de sus causas (11). En el caso de la existencia de fracturas, es necesario el conocimiento de los fármacos utilizados en el tratamiento del dolor crónico y su posible interacción con la medicación empleada en otras enfermedades muy prevalentes en la población de edad avanzada, como la hipertensión arterial, la diabetes mellitus y la hipercolesterolemia.
La osteoporosis (OP) es la enfermedad metabólica ósea más frecuente, responsable de la mayor parte de las fracturas que se producen en personas mayores de 50 años, entre las que destacan las fracturas de vértebras, de la extremidad distal de antebrazo y de la proximal de fémur (2).
Hasta hace relativamente poco tiempo, el diagnóstico de OP sólo se realizaba una vez que se había producido la fractura, por lo que, siendo muy específico, resultaba tardío y poco sensible. El uso de la densitometría ósea en la década de los 80 permitió observar la relación existente entre la disminución de la masa ósea y el riesgo de fractura, por lo que se extiende un concepto de OP basado exclusivamente en la cantidad de masa ósea, sin exigir la existencia de fractura. El hueso, disminuido en cantidad, tiene una mineralización normal, diferenciándose de la alteración de la mineralización existente en la osteomalacia.
En 1991, en una Conferencia Consenso, se define a la OP como “una enfermedad sistémica caracterizada por una masa ósea baja y un deterioro de la microarquitectura esquelética”, lo que conlleva a un aumento de la fragilidad ósea y, por tanto, del riesgo de fractura (1).
En esta definición, aun predominando el concepto cuantitativo (“masa ósea baja”), se comienza a vislumbrar el hecho de que existe algo más, el añadir “...y deterioro de la microarquitectura”, lo que viene a significar que no es únicamente un problema de disminución de cantidad sino también de alteración de la calidad. Sin embargo, durante toda la década de los 90 ha predominado el concepto cuantitativo, reforzado por la propuesta realizada en 1994 por un grupo de expertos de la OMS para establecer una clasificación de gran valor práctico, comparando la masa ósea medida por densitometría (DMO) de una persona determinada con la media del “pico de masa ósea” que se alcanza al final de la juventud (T score).
La experiencia acumulada ha demostrado, sin embargo, que la masa ósea no es el único determinante del riesgo. Se sabe que hay mucha superposición en los valores de masa ósea cuando se comparan poblaciones (con y sin fractura) sin que la cantidad de masa ósea pueda predecir la presencia o no de la fractura. El antecedente de una fractura por fragilidad aumenta el riesgo de una nueva fractura, independientemente de la masa ósea, y pequeñas pérdidas en lugares estratégicos (rotura de trabéculas) disminuye mucho la resistencia y aumenta la propensión a las fracturas (9). Por otro lado, numerosos ensayos clínicos con fármacos antirresortivos han evidenciado que no hay correlación entre el cambio que producen en la masa ósea y la disminución del riesgo de fractura, mientras que, con la misma masa ósea, una persona de 70 años tiene mucho más riesgo de padecer una fractura osteoporótica que otra de 40 años (5).
Clasificación
Atendiendo a la causa productora de la OP, podemos considerar dos grupos bien diferenciados:
1.- Osteoporosis involutiva:
Como su nombre indica, se produce con el transcurso de los años, especialmente en la mujer después de la menopausia, entre los 50 y 75 años (OP posmenopáusica o tipo I) y tanto en la mujer como en el varón en edades más avanzadas, por encima de los 70 años (OP senil o tipo II) (7).
OP posmenopáusica o tipo I: se produce en la mujer como consecuencia del cese de la función ovárica; la pérdida ósea se acelera y afecta especialmente al hueso trabecular, siendo características las fracturas vertebrales por aplastamiento y de la extremidad distal del antebrazo.
OP senil o tipo II: se produce en ambos sexos, en edades más avanzadas, consecuencia de la pérdida de cantidad y alteración de la calidad ósea que progresivamente tiene lugar con el transcurso de los años. Esta pérdida no es tan acelerada como en el tipo I y afecta tanto a hueso trabecular como cortical, siendo características la fractura de cadera, además de las de pelvis, húmero proximal y vértebras (cuñas múltiples). Las características diferenciales de estos dos tipos de osteoporosis involutivas, propuestas y defendidas por Riggs (10), se encuentran resumidas en la tabla 1.
Tabla 1: Características diferenciales de los dos tipos de osteoporosis involutiva
|
|
Tipo I (Posmenopáusica) |
Tipo II: Senil |
|
Edad (años) |
50- 75 |
> 70 |
|
Sexo (F/M) |
6 / 1 |
2 / 1 |
|
Hueso Afectado |
Trabecular |
Trabecular y Cortical |
|
Velocidad de Pérdida |
Acelerada |
No acelerada |
|
Fracturas |
Vértebras (Aplastamiento) |
Cadera |
|
|
Distal antebrazo |
Humero |
|
|
Vértebras (cuñas) |
Cadera |
|
Función Paratifoidea |
Disminuida |
Aumentada |
|
Causa |
Déficit de Estrógenos |
Envejecimiento |
2.- Osteoporosis secundaria
Se utiliza tal denominación cuando existe una causa capaz de producir el trastorno, independientemente de la menopausia y la edad. Las posibles etiologías son muy numerosas, resaltando diferentes enfermedades endocrinológicas, gastrointestinales, hematológicas o conectivopatías, así como la inmovilización prolongada o el uso de distintos fármacos.
Tabla 2 Causas conocidas de osteoporosis secundarias

Para el médico especialista es muy importante el conocimiento de la osteoporosis secundaria al uso de glucocorticoides, por su elevada frecuencia y gravedad. Los glucocorticoides producen disminución de la absorción intestinal de calcio y vitamina D e hiperparatiroidismo secundario, junto con una disminución de la actividad osteoblástica y exceso de acción osteoclástica, con el consiguiente efecto pernicioso para el hueso.
Por ello, es obligatorio utilizar siempre la dosis de glucocorticoides más baja posible durante el mínimo tiempo necesario y, cuando se prevea una dosis elevada y/o un tiempo largo, realizar una valoración de riesgo y tratamiento profiláctico. Los corticoides inhalados, aunque son mucho menos nocivos, no están totalmente exentos de riesgo( 3).
Merece, también, resaltarse el efecto tan nocivo del abuso del alcohol y tener siempre en cuenta en el uso a largo plazo de anticomiciales. Nunca se debe olvidar el hipertiroidismo, a veces larvado, que puede actuar solo o complicando a cualquier otro tipo de osteoporosis; por ello, la determinación de los niveles séricos de hormonas tiroideas resulta obligada ante la más mínima sospecha.
Epidemiología
El cambio en la expectativa de vida aumenta en forma progresiva en la población mundial, de una manera rápida y continua en países desarrollados y mucho más lenta en países en vías de desarrollo esperando que no antes de un lapso de 30 años esta tendencia continúe mejorando lo cual tendrá un enorme impacto en la estructura de nuestra Sociedad, que cada día envejecerá más y será presa de enfermedades crónicas y degenerativas como la osteoporosis.
Las cifras con más alta expectativa de vida se encuentran en regiones con alto grado de desarrollo como Norte América, Europa, Oceanía y algunas zonas de Asia del Este y Rusia. Países como Japón, Suiza y Suecia tienen las expectativas más altas del mundo tanto en hombres como en mujeres en tanto que en Gambia y Etiopía en el África se reportan las más bajas (Tabla 3). En la totalidad de los países del mundo esta expectativa de vida es mucho mayor en mujeres que en hombres, mayoría que oscila entre 3 y 7 años. Una vez alcanzados los 65 años, países como Japón, Francia y Suiza alcanzan la mayor expectativa de vida en promedio con cifras de 16.5, 15.7 y 15.5 respectivamente.
Tabla 3. Expectativa de vida
|
País |
Mujeres |
Hombres |
|
Japón |
81.8 |
75.9 |
Como consecuencia del cambio en la expectativa de vida los grupos de personas con mayor edad han venido incrementándose progresivamente y la proyección a nivel mundial calcula un aumento de la población total partiendo con referencia del año 1980 hasta una cifra estimada en el año 2000 de un 38% en tanto que la población mayor de 60 años se elevará en un 57.1%; Estados Unidos es un claro ejemplo de estos cambios, en 1950 la población mayor de 60 años llegó a 18,5 millones aumentando a 37 millones en 1985 y en el año 2000 una cifra de 67 millones. La población mundial en 1980 fue calculada en 4432 millones y en el año 2000 se estima que existió 6119 millones (4).
En el Perú, la incidencia de la enfermedad es de 179 a 100,000 mujeres (0.17%). Es decir, más de 23 mil mujeres peruanas padecen osteoporosis, según los datos actualizados publicados por la Sociedad Peruana de Osteoporosis. Asimismo, se estima que el 50% de las personas mayores de 50 años padecen de osteoporosis y solamente el 20% se encuentra en tratamiento médico.
Fisiopatología general
Se encuentra bastante determinado por factores genéticos, como lo demuestra el hecho de que los hijos de mujeres con OP tienen menor masa ósea que los hijos de mujeres sin OP y la concordancia de masa ósea es mayor en gemelos univitelinos que en bivitelinos. Distintos genes, incluyendo el gen del receptor de vitamina D, de estrógenos y de IL-6, han sido estudiados en relación a la masa ósea, sin que se hayan demostrado relaciones claras.
Sí parece existir relación con el polimorfismo Sp1 del gen de la cadena alfa-1 del colágeno 1 (COLIA 1), habiéndose demostrado asociación con masa ósea baja e incremento del riesgo de fractura. Recientemente se ha descrito una mutación del gen de la proteína 5 relacionada con el receptor de LDL (LRP 5) asociada a masa ósea alta (14).
Figura 1. Evolución de la masa ósea en el transcurso de la vida
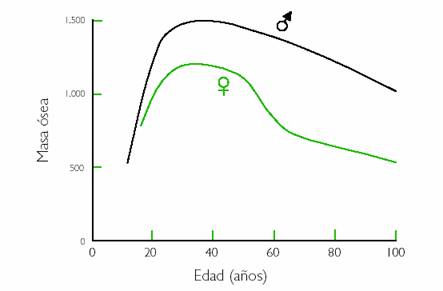
Una vez alcanzado el “pico de masa ósea”, el esqueleto adulto se renueva continuamente por la acción sucesiva y acoplada de los osteoclastos, que destruyen hueso, y de los osteoblastos, que forman hueso nuevo para sustituir al viejo destruido por los osteoclastos.
A este proceso se le denomina “remodelado óseo”, tiene lugar en múltiples “unidades de remodelado” de la superficie del hueso y está regulado con precisión, tanto por productos de la circulación general (hormonas) como por factores locales. Entre las hormonas reguladoras destacan la PTH, calcitonina, insulina, GH, vitamina D, glucocorticoides, estrógenos, andrógenos y hormonas tiroideas. De las moléculas locales, son importantes los factores de crecimiento insulínico,TGF-b, factores de crecimiento fibroblástico, PDGF, y otras citocinas, como IL-1, IL-6, IL-11,TNF-a y factores estimulantes de colonias (M-CSF).
En cada unidad de remodelado , el ciclo comienza con la estimulación de células de estirpe osteoblástica en la médula ósea. La PTH y algunos factores locales (IL-1 y TNF-a) estimulan en estas células en reposo (lining cells) la producción de colagenasa, que lleva a cabo la disolución de la matriz ósea, liberándose de ella productos (osteopontina, sialoproteína y fragmentos del colágeno degradado) que activan y atraen a los osteoclastos.
Figura 2. Ciclo de actividad celular y remodelación ósea
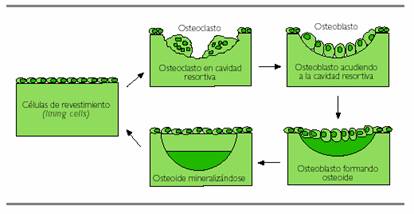
Éstos se adhieren a la matriz ósea y forman el “borde en cepillo” por el que realizan la resorción gracias a la acción especial de la catepsina K, tras la liberación de hidrogeniones al medio. Cuando se ha destruido una cantidad determinada de hueso en la unidad de remodelado, ésta debe ser reemplazada por hueso nuevo, lo que sucede a través de las siguientes fases: a) cese de la actividad osteoclástica; b) atracción de los precursores de osteoblastos a la cavidad resortiva; c) proliferación y diferenciación de los precursores de osteoblastos; d) formación de la matriz ósea y e) cese de la actividad de osteoblastos (11).
El cese de la actividad osteoclástica se produce por el aumento local de productos liberados de la matriz ósea, como Ca, P y TGF-b, interviniendo este último factor también en la quimiotaxis y proliferación de los precursores osteoblásticos. Las proteínas morfogenéticas óseas (BMP) activan la diferenciación de los osteoblastos para formar hueso, que posteriormente se mineraliza. Una vez terminada la formación, la superficie del hueso se cubre con osteoblastos muy diferenciados (lining cells) en reposo, que se activarán en un ciclo posterior.
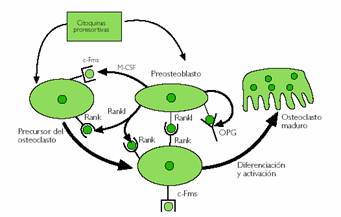
El RANK (Receptor for Activation of Nuclear Factor KB; NFkB) es un receptor de los osteoclastos, al que se une el RANKL (ligando de RANK) presente en la membrana de las células de estirpe osteoblástica y del estroma medular. Esta unión estimula la proliferación y actividad de los osteoclastos, inhibiendo su apoptosis. Por otro lado, los osteoblastos producen un receptor soluble, osteoprotegerina (OPG), que es capaz de unirse al RANKL, impidiendo la unión RANK-RANKL, por lo que su acción es inhibidora de la actividad osteoclástica(16). Es, por tanto, la relación entre RANKL y OPG lo que determina la cantidad de resorción ósea. El osteoblasto produce, además, el factor estimulante de colonias de monocitos (M-CSF), que se une al receptor C-Fms de los osteoclastos, siendo también necesario para la osteoclastogénesis y complementario a la acción del sistema RANK-RANKL
En condiciones normales, la fase de resorción ósea del remodelado dura unas 2 semanas y la formación unos 3 meses. En el adulto joven, la masa ósea se mantiene porque existe un equilibrio entre la actividad de osteoclastos y osteoblastos y la cantidad de hueso formado y destruido es similar. En estas condiciones de normalidad se calcula que al cabo de un año se renueva el 4-5% del hueso cortical y el 25% del hueso trabecular.
Figura 3. Acción del sistema RANK-RANKL-OPG en el remodelado óseo.
Con la menopausia se produce una situación de alto remodelado óseo, con aumento del número de unidades de remodelado activas y un desequilibrio osteoclasto-osteoblasto, con aumento de la actividad osteoclástica en cada una de ellas, lo que da lugar a una pérdida acelerada de masa ósea que afecta fundamentalmente al hueso trabecular y que puede alcanzar un 4-6% a nivel vertebral el 2º año y un 8-13% el 3er año después de la menopausia. En conjunto, se atribuye a la menopausia la responsabilidad directa de casi el 50% de la pérdida de masa ósea en la mujer a lo largo de la vida, lo que la hace mucho más propensa que el varón a padecer osteoporosis.
Todo ello se debe al déficit de la función ovárica. En efecto, se sabe que los estrógenos disminuyen la actividad osteoclástica inhibiendo la producción de M-CSF, RANKL, IL-1, IL-6 y TNF-a, al tiempo que estimulan la producción de OPG y TGF-b, por lo que su déficit tras la menopausia invierte todas estas acciones y condiciona la pérdida acelerada de masa ósea(18).
La resorción ósea exagerada, a través del calcio que extrae el hueso, tiende a elevar los niveles de calcemia, lo que conlleva una disminución de la secreción de PTH y de la producción de 1,25 (OH) 2D3, por lo que disminuye la absorción intestinal de calcio y aumenta la eliminación urinaria del mismo, cerrándose el círculo de las alteraciones fisiopatológicas
Tabla 4 . Principales factores de riesgo de osteoporosis.

Figura 4. Fisiopatología general de la producción de osteoporosis y fracturas.
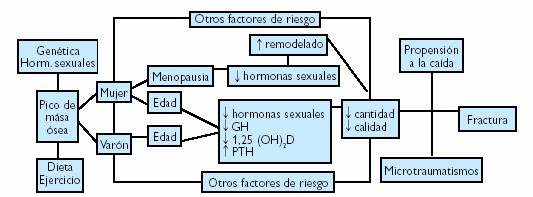
La osteoporosis es una enfermedad completamente asintomática durante gran parte de su evolución, apareciendo síntomas y signos clínicos únicamente en los estados muy avanzados del proceso, cuando se producen las fracturas. Esto hace que se considere a la osteoporosis como una “epidemia silenciosa”, contra la que sólo puede lucharse valorando a las personas en riesgo a fin de realizar un diagnóstico precoz y una prevención eficaz.
Una vez que se produce la fractura, la clínica es tan típica que lleva a un diagnóstico correcto en la mayor parte de los casos (cadera, antebrazo, húmero, pelvis, etc.). Consideración aparte merecen las fracturas vertebrales, ya que no siempre producen síntomas tan manifiestos. Suelen producirse con traumatismos o esfuerzos mínimos, como empujar un coche o elevar un peso pequeño, movimientos de rotación de la columna e incluso al toser o levantarse.
Es importante señalar que sólo la mitad de las fracturas vertebrales presentan clínica llamativa, con dolor agudo. El resto no tienen dolor o presentan pequeñas molestias que se achacan a contractura muscular, fibromialgia u otras causas específicas, descubriéndose las fracturas de forma casual al realizar un estudio radiológico por molestias crónicas u otras causas(6). Esto sucede en un número importante de pacientes con osteoporosis senil y acuñamientos vertebrales múltiples.
En los restantes casos, la fractura vertebral produce un dolor agudo, intenso, localizado a nivel de la vértebra dañada e incapacitante, que aumenta en bipedestación y disminuye con el reposo en cama. El dolor se exacerba con la tos, estornudo y defecación, manteniéndose durante aproximadamente un mes con el tratamiento adecuado, aunque ocasionalmente se prolonga hasta 4-6 meses. Posteriormente puede quedar un dolor crónico difuso, proporcional en intensidad al número de fracturas existentes, debido a la alteración de la estática y consiguiente sobrecarga muscular.
Tratamiento
A pesar de que no hay cura para la osteoporosis, la Administración de Drogas y Alimentos (Food and Drug Administration, FDA) de los Estados Unidos ha aprobado varios fármacos para el tratamiento de la osteoporosis, entre ellos la calcitonina, los bisfosfonatos (como por ejemplo, el alendronato y el risedronato) y los moduladores selectivos de los receptores de estrógeno (SERM, por sus siglas en inglés), incluido el raloxifeno. Cada uno de estos tratamientos tiene beneficios y riesgos únicos.
¿Cómo funcionan los medicamentos para la osteoporosis?
La osteoporosis se produce cuando el proceso que elimina el hueso viejo y lo reemplaza con hueso nuevo se desequilibra. El hueso se reduce (reabsorbe) con más rapidez de lo que se reemplaza por lo que los huesos se debilitan y pueden fracturarse. En la actualidad, los medicamentos que previenen o tratan la osteoporosis actúan en la reabsorción ósea (inhibidores de la reabsorción) o en la formación ósea (anabolizante).
La prevalencia de hipovitaminosis D es mucho más alta y la administración de esta vitamina es un tratamiento interesante en un país que tiene un porcentaje importante de población de bajos ingresos y que necesita un tratamiento preventivo para la osteoporosis; pero no queda claro si es eficaz como tratamiento único, porque sólo existen dos estudios aleatorios en los que se demuestra que la asociación de calcio y vitamina D reduce el riesgo de fracturas, en pacientes de casas de reposo y en pacientes con osteoporosis.
Hay varios otros tratamientos: bifosfonatos, Alendronato, Risedronato, Raloxifeno, terapia con estrógenos y PTH, que son muy eficaces cuando se usan selectivamente en pacientes con osteoporosis, pero la terapia actual presenta
Algunos problemas y su costo es muy elevado.
El principal problema
con la terapia actual es la adhesión: 50% a 70% de las pacientes a las que se
les indica tratamiento para la osteoporosis lo han suspendido un año después, lo
que también ocurre en los pacientes que han estado hospitalizados por
fractura(8). La PTH forma hueso, pero no se puede tomar por vía oral, que muchos
pacientes prefieren, y además tiene una limitación de tiempo y aquí se trata de
un tratamiento más largo.
Estradiol
Es una propuesta nueva e interesante: las dosis pequeñísimas de estradiol pueden mejorar la densidad y el recambio óseos con muy poco efecto de estimulación uterina, y tal vez no se necesite una terapia con progesterona, pero quedan muchas preguntas sin responder, por ejemplo, si se resuelven los síntomas, la dispareunia, etc. Se necesitaría un estudio mucho más grande para afirmar que este tratamiento es seguro, y aunque la FDA lo aprobará el próximo año, todavía faltan un par de años para que se pueda aplicar en la clínica.
Bifosfonatos
Probablemente, los bifosfonatos de acción prolongada serán un arma importante de tratamiento. Los bifosfonatos de gran potencia se unen fuertemente al hueso y se liberan durante su reabsorción, a lo largo de meses y años. Los más potentes son Alendronato y Clodronato, que se unen a la superficie del hueso y se liberan en la zona en la que actúan los osteoclastos, pero, luego de la liberación, los bifosfonatos, por reciclaje, vuelven a unirse al hueso en la misma zona. Este reciclaje es el que logra que la acción de estos medicamentos sea tan larga; en el caso de Clodronato, una sola dosis de 4 mg reduce el recambio óseo por no menos de un año, quizás más, y esa misma dosis mejora la densidad ósea en 4%, efecto que dura 12 meses por lo menos.
La administración por vía parenteral, endovenosa, una vez al año, podría tener la gran ventaja de superar la escasa adhesión al tratamiento y quizás no habría que preocuparse porque 50% a 70% de las pacientes abandonan el tratamiento oral, de modo que esta forma de tratamiento es especialmente útil para las que no pueden o no quieren cumplir el tratamiento oral, como también en las pacientes
De alto riesgo hospitalizadas.
Estas pacientes generalmente no están a cargo de especialistas en osteoporosis y los médicos tratantes no siempre piensan prevenir este problema, a pesar del alto riesgo de fracturas secundarias a la rápida pérdida de masa ósea, aun cuando se haga rehabilitación. El riesgo de sufrir una fractura en el primer año después de un AVE es siete veces mayor que en pacientes sin AVE y se mantiene alto durante varios años; este grupo debería recibir tratamiento durante uno o dos años, para disminuir el riesgo de fractura después del AVE, lo que se podría lograr con una sola inyección durante la hospitalización.
Este tratamiento está
actualmente en proceso de aprobación y Clodronato está en estudio para
determinar su utilidad en la reducción del riesgo de fracturas; de ser así,
estaría disponible en el mercado en dos o tres años más.
Anticuerpo monoclonal para RANKL
El sistema OPG/RANKL es muy importante en el control de la resorción del hueso. La unión de RANK (Receptor del Activador del Factor Nuclear Kappa-B) con su ligando, RANKL, induce la activación de una cascada de episodios intracelulares que llevan a la diferenciación y activación de los osteoclastos. Muchos mecanismos, cuando no todos los que controlan la resorción ósea por los osteoclastos, funcionan por medio de este sistema.
Por su parte, la
osteoprotegerina (OPG) es una proteína que inhibe el desarrollo de los
osteoclastos e impide la pérdida de hueso; los niveles altos de OPG detienen la
resorción ósea. No se puede administrar la OPG como un medicamento, porque el
organismo reaccionaría produciendo anticuerpos antiOPG. Es interesante saber que
los ratones con disminución del gen OPG, en los cuales el sistema RANKL está muy
activo y provoca la resorción ósea, apenas tienen hueso, pero sí tienen una
extensa calcificación de las arterias(13). Por lo tanto, quizás tratando a las
pacientes con algo que tenga un efecto similar a OPG se podría conservar la masa
ósea y además, reducir la calcificación arterial.
En un estudio,
recientemente publicado, acerca de la seguridad y del grado de efecto
antirresortivo de una dosis única subcutánea de AMG 162, un anticuerpo
monoclonal humano contra RANKL, administrado a 49 mujeres postmenopáusicas, se
observó una reducción impresionante de la resorción ósea en uno o dos días,
efecto que duró 6 meses (J Bone Miner Res 2004 Jul;19(7):1059-66). Este
anticuerpo es muy específico, no causa reacción inmune y provoca una reducción
extrema en los marcadores de resorción ósea.
Este medicamento es una alternativa muy interesante que estará disponible dentro de tres o cuatro años, si los estudios resultan satisfactorios. Es interesante por sus bases fisiológicas, por su potencia, por el hecho de que se administraría por vía parenteral cada seis meses, lo que evitaría los problemas de adhesión, y por la posibilidad, un poco más lejana, de que también pudiera disminuir la calcificación vascular.
Ranelato de estroncio
Otro medicamento que podría estar disponible pronto, cuyo mecanismo de acción es muy interesante, es el ranelato de estroncio, que se caracteriza por ser bivalente, o sea, por tener dos polos positivos, al igual que el calcio, al que podrá reemplazar en muchas reacciones.
Cuando este compuesto
entra en el organismo, sigue el mismo camino que el calcio, siendo absorbido por
el intestino, utilizado por el hueso y secretado por el riñón, de modo que el
estroncio podría reemplazar al calcio en la matriz ósea y aumentar la
resistencia de ésta a la resorción. Además, estimula la proliferación y
actividad de los osteoblastos y aumenta los marcadores de formación de hueso
(11).
Estos datos provienen de un estudio publicado recientemente, en el que se comprobó una mejoría importante de la densidad ósea en un lapso de tres años. En este tipo de estudios, las mediciones de densidad deben hacerse en forma cuidadosa, porque el hueso no contiene sólo calcio, sino también estroncio, que es más pesado, por lo que la mejoría en la densidad ósea podría estar sobreestimada(12). Pues bien, en el estudio descrito se corrigieron las cifras según el peso del estroncio y se demostró que existía un aumento real de la densidad ósea y, lo más importante, que la recurrencia de fracturas vertebrales se redujo en 40% en las pacientes tratadas con estroncio.
Este compuesto es bastante seguro; sólo provoca diarrea ocasionalmente. Pronto ofrecerá una alternativa frente a los bifosfonatos, Raloxifeno y estrógenos, y puede llegar a ser el tratamiento de primera línea para la osteoporosis. Estaría disponible el próximo año en los Estados Unidos y, en Chile, dos o tres años después.
El óxido nítrico (NO) es una molécula muy potente, que está presente todos los sistemas; se produce localmente en los tejidos en forma aleatoria y se transporta hacia el resto del organismo. Los estudios indican que participaría en muchos de los efectos de los estrógenos, como la vaso dilatación, la formación ósea y quizás incluso la resorción, y que es un mediador de los efectos óseos del ejercicio, puesto que el bloqueo de la síntesis de NO anula el efecto de éste sobre la formación ósea(17).
Los grandes estudios sobre del efecto de los nitratos han demostrado que son seguros para los pacientes con enfermedades cardiovasculares, lo que, unido a su bajo costo y amplia disponibilidad en todo el mundo, podría convertirlos en un método seguro, barato y universal para prevenir la osteoporosis. Actualmente se está realizando un estudio acerca de sus efectos en la densidad ósea y pronto, probablemente, se investigará su repercusión sobre el riesgo de fracturas. También se está estudiando el uso de PTH oral y de bloqueadores de los Receptores de calcio.
Estamos viviendo momentos muy interesantes en la investigación de la osteoporosis, porque han surgido muchos nuevos tratamientos que podrían resolver los problemas de los antiguos tratamientos, como la adhesión, y lograr mayor formación ósea sin ocasionar efectos deletéreos. Los nitratos aparecen como una nueva opción de bajo costo y alcance universal para la prevención de la osteoporosis, pero muchos de estos tratamientos aún necesitan más estudio para demostrar que son seguros y eficaces. Por el momento, lo importante para todos los países, y para la salud pública en general, es que la vitamina D sí funciona.
CONCLUSIONES
1. Durante la menopausia se produce un desequilibrio osteoclasto-osteoblasto, dando como resultado una pérdida acelerada de la masa ósea, fundamentalmente del hueso trabecular.
2. Actualmente existen medicamentos como los bifosfonatos como los alendronato , risendronato, clodronato, y otras drogas de acción prolongada que mejoran la densidad ósea que en algunos casos su efecto tiene una duración de 12 meses aproximadamente.
3. Los bifosfonatos son medicamentos que actúan en la reabsorción ósea y/o formación ósea, pero que presenta algunos problemas por su elevado costo.
4. La administración de la vitamina D y calcio, es una buena alternativa como medida preventiva y que puede reducir el riesgo de fracturas en pacientes con osteoporosis, y cuya ventaja que tiene un bajo costo para los pacientes.
5. La Paratohormona es un medicamento que forma hueso, pero su dosificación no puede realizarse por vía oral, y su tratamiento es prolongado.
6. La administración de la terapia hormonal de baja dosis (estradiol) ofrece beneficios en el recambio óseo y mejora la densidad con muy poco efecto de estimulación endometrial.
7. La administración por vía parenteral de algunas drogas (dosis anual) puede tener grandes beneficios para superar la escasa adhesión al tratamiento y disminuir la tasa de abandono del tratamiento por vial oral, ofreciendo mejores beneficios para los pacientes.
REFERENCIAS BIBLIOGRAFICAS
1. UNO. Demographic indicators of countries. Estimates and projections as assessed in 1980. United Nations Publications, New York 1982.
2. Britannica Book of Year, Chicago: Encyclopedia Britannica Inc 1991.
3. World Health Statistical; Annual, 1990.
4. Riggs BL, Melton LJ III. N Engl J Med 1986; 314: 1676-1684.
5. Melton LJ, Chao EYS, Lane J. In Riggs BL, Melton LJ, eds. Osteoporosis, Etiology, Diagnosis and Treaatment. Raven Press, New York, 1988.
6. Riggs BL, Whaner W, Seeman E et al. Changes in bone mineral density of the proximal femur and spine with aging: differences between the posmenopausal and senile osteoporosis syndrome. J Clin Invest, 1982; 70: 716-723.
7. Vader JP y Col. Hip fractures incidence- Switzerland. In: Osteoporosis 1990; 1: 98-100. Eds.. Christiasen C and Overgaard K,1990.
8. Seeman E, Vellas B, Roux C, et al. Primera demostración de la eficacia de un tratamiento antiosteoporótico en mujeres osteoporóticas de edad avanzada. ASBMR 2004.
9. Center JR, Nguy TV, Schneider D et al. Mortalidad tras los principales tipos de fracturas provocadas por la osteoporosis en hombres y mujeres: un estudio de observación. 1999; 353:878-882.
10. Marie PJ, Ammann P, Boivin G, et al. Mecanismos de acción y potencial terapéutico del estroncio en los huesos. Calcif Tissue Int. 2001; 69:121-129.
11. Ammann P. Ranelato de Estroncio: modo de acción y beneficios para la calidad ósea. Osteoporos Int. 2003; 14: S105. SY21.
12. Meunier PJ, Roux C, Seeman E, et al. Los efectos del ranelato de estroncio en el riesgo de fracturas vertebrales en mujeres con osteoporosis postmenopáusica. N Engl J Med.2004; 350: 459-468.
13. Lard LR, Visser H, Séller I, Vander Horst-Bruinsma IE, Zwinderman AH, Breedveld FC, et al. Early versus delayed treatment in patients withrecent-onset rheumatoid arthritis: comparison of two cohorts whoreceived different treatment strategies.Am J Med 2001; 111: 446-51.
14. Juby AG, Davis P, McElhaney JE, Gravenstein S. Prevalence of selected autoantibodies in different elderly subpopulation, Br J Rheumatol 1994;33: 1121-4.
15. Shmerling RH, Delbanco TL. How useful is the rheumatoid factor? An analysis of sensitivity, specificity, and predictive value. Arch Intern Med 1992; 152: 2417-20.
16. O´Dell JR.Treating rheumatoid arthritis early: a window of opportunity? Arthritis Rheum 2002; 46: 283-5.
17. Hm SL, Slemenda CW, Johnston CC Jr.Age and bone mass as predictors of fracture in a prospective study. J Clin Invest 1988; 81: 1804-9.
18. Arnett FC, Edworthy SM, Bloch DA, McShane DJ, Fries JF, Cooper NS, et al. The American Rheumatism Association 1987 revised criteria for the classification of rheumatoid arthritis.Arthritis Rheum 1988; 31: 315-24.
19. Smolen JS. Autoantibodies in rheumatoid arthritis. En:Van Venrooj WK, Maini RN, editors. Manual of biological markers of disease. Dordrecht (The Netherlands): Kluwer Academic Publishers 1996; 1-18.
20. Goldstein SA, Goulet R, McCubbrey D. Measurement and significance of three-dimensional architecture to the mechanical integrity of trabecular bone. Calcif Tissue Int 53 (Suppl): S127-S133.
21. Vázquez MA, Montoya MJ, Gómez de Tejada MJ, et al. Niveles séricos de osteoprotegerina en mujeres sanas y osteoporóticas. REEMO 2003; 12(3): 63-7.
22. Pérez R, Gómez de Tejada MJ. Bases clínicas y densitoméricas en eldiagnóstico. En:Alteraciones del metabolismo mineral en Endocrinología.E. Escobar y F. Hawkins(eds) Madrid:Aula Médica 2002; 37-50.
|
Recibido: 10/03/2008 |
Aceptado: 22/04/2008 |
______________________________________________
1. Vicerrector Administrativo de la Universidad Norvert Wiener.
2. Asistente Administrativo del Vicerrectorado de la Universidad Norvert Wiener